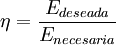La termodinámica es la rama de la física que describe los estados de equilibrio a nivel macroscópico . Constituye una teoría fenomenológica, a partir de razonamientos deductivos, que estudia sistemas reales, sin modelizar y sigue un método experimental. Los estados de equilibrio son estudiados y definidos por medio de magnitudes extensivas tales como la energía interna, la entropía el volumen o la composición molar del sistema , o por medio de magnitudes no-extensivas derivadas de las anteriores como la temperatura, presión y el potencial químico; otras magnitudes tales como la imanación, la fuerza electromotriz y las asociadas con la mecánica de los medios continuos en general también pueden ser tratadas por medio de la Termodinámica.
Fórmulas
El calor se puede representar en Julios o en Calorías. Una Caloría son 4,18 J. Un Julio son 0,24 Cal.
La temperatura se mide en grados centígrados y Kelvin. Un kelvin son 273 grados centígrados.
El calentamiento de líquidos y solidos sin cambio de estado viene dado por la siguiente ecuación: Q=m·c·At
El calentamiento de gases es menos importante.
Transformaciones en un sistema termodinámico
Isoterma |
Isoterma e Adiabática |
Isobara |
Isocora |
En la transformación Isobara, la presión se mantiene constante.
En la transformación Isocora, el volumen se mantiene constante.
En la transformación Isoterma, la temperatura no cambia.
En la transformación Adiabática, no se intercambia calor, y es un proceso reversible.
PRIMER PRINCIPIO DE LA TERMODINÁMICA
El primer principio de la termodinámica o primera ley de la termodinámica, se postula a partir del siguiente hecho experimental: En un sistema cerrado adiabático que evoluciona de un estado inicial a otro estado final , el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido. Mas formalmente, este principio se descompone en dos partes; El «principio de la accesibilidad adiabática» El conjunto de los estados de equilibrio a los que puede acceder un sistema termodinámico cerrado es, un conjunto simplemente conexo. y un «principio de conservación de la energía»: El trabajo de la conexión adiabática entre dos estados de equilibrio de un sistema cerrado depende exclusivamente de ambos estados conectados. Este enunciado supone formalmente definido el concepto de trabajo termodinámico, y sabido que los sistemas termodinámicos solo pueden interaccionar de tres formas diferentes. En general, el trabajo es una magnitud física que no es una variable de estado del sistema, dado que depende del proceso seguido por dicho sistema. Este hecho experimental, por el contrario, muestra que para los sistemas cerrados adiabáticos, el trabajo no va a depender del proceso, sino tan solo de los estados inicial y final. En consecuencia, podría ser identificado con la variación de una nueva variable de estado de dichos sistemas, definida como energía interna.
AU=Q-W, donde W es el trabajo, Q es el calor, y AU es el incremento de energía interna
SEGUNDO PRINCIPIO DE LA TERMODINÁMICA
Es una de las leyes más importantes de la física; aún pudiéndose formular de muchas maneras todas llevan a la explicación del concepto de irreversibilidad y al de entropía. Este último concepto, cuando es tratado por otras ramas de la física, sobre todo por la mecánica estadística y la teoría de la información, queda ligado al grado de desorden de la materia y la energía de un sistema. La termodinámica, por su parte, no ofrece una explicación física de la entropía, que queda asociada a la cantidad de energía no utilizable de un sistema. Sin embargo, esta interpretación meramente fenomenológica de la entropía es totalmente consistente con sus interpretaciones estadísticas. Así, tendrá más entropía el agua en estado gaseoso con sus moléculas dispersas y alejadas unas de las otras que la misma en estado líquido con sus moléculas más juntas y más ordenadas.
El segundo principio de la termodinámica dictamina que si bien la materia y la energía no se pueden crear ni destruir, sí que se transforman, y establece el sentido en el que se produce dicha transformación. Sin embargo, el punto capital del segundo principio es que, como ocurre con toda la teoría termodinámica, se refiere única y exclusivamente a estados de equilibrio.
Existe un proceso reversible, un proceso irreversible, y la entropia, dada por la siguiente ecuación: AS=Q/T
Proceso reversible: Se denominan procesos reversibles a aquellos que hacen evolucionar a un sistema termodinámico desde un estado de equilibrio inicial a otro nuevo estado de equilibrio final a través de infinitos estados de equilibrio.
Estos procesos son procesos ideales, ya que el tiempo necesario para que se establezcan esos infinitos estados de equilibrio intermedio sería infinito.
La variación de las variables de estado del sistema, entre uno de estos estados de equilibrio intermedio y el sucesivo es una variación infinitesimal, es decir, la diferencia que hay entre el valor de una de las variables en un estado y el siguiente es un infinitésimo.
Un proceso reversible es aquel en que se puede hacer que el sistema vuelva a su estado original, sin variación neta del sistema ni del medio exterior.
Proceso irreversible: Se aplica a aquellos procesos que, como la entropía, no son reversibles en el tiempo. Desde esta perspectiva termodinámica, todos los procesos naturales son irreversibles. El fenómeno de la irreversibilidad resulta del hecho de que si un sistema termodinámico de moléculas interactivas es trasladado de un estado termodinámico a otro, ello dará como resultado que la configuración o distribución de átomos y moléculas en el seno de dicho sistema variará.
Cierta cantidad de "energía de transformación" se activará cuando las moléculas del "cuerpo de trabajo" interaccionen entre sí al cambiar de un estado a otro. Durante esta transformación, habrá cierta pérdida o disipación de energía calorífica, atribuible al rozamiento intermolecular y a las colisiones.
Lo importante es que dicha energía no será recuperable si el proceso se invierte.
Entropía: Es la magnitud física que mide la parte de la energía que no puede utilizarse para producir trabajo. Es una función de estado de carácter extensivo y su valor, en un sistema aislado, crece en el transcurso de un proceso que se dé de forma natural. La entropía describe lo irreversible de los sistemas termodinámicos. La palabra entropía significa evolución o transformación. Fue Rudoulf Clausius quien le dio nombre y la desarrolló durante la década de 1850. Y Ludwig Boltzman quien encontró la manera de expresar matemáticamente este concepto, desde el punto de vista de la probabilidad.
Ciclo de Carnot
El ciclo de Carnot se produce cuando una máquina trabaja absorbiendo una cantidad de calor Q1 de la fuente de alta temperatura y cede un calor Q2 a la de baja temperatura produciendo un trabajo sobre el exterior. El rendimiento viene definido, como en todo ciclo, por
Rendimiento= Wext/Q1 = Q1-Q2/Q1 = 1-Q2/Q1
y, como se verá adelante, es mayor que cualquier máquina que funcione cíclicamente entre las mismas fuentes de temperatura. Una máquina térmica que realiza este ciclo se denomina máquina de Carnot.
Rendimiento= Wext/Q1 = Q1-Q2/Q1 = 1-Q2/Q1
y, como se verá adelante, es mayor que cualquier máquina que funcione cíclicamente entre las mismas fuentes de temperatura. Una máquina térmica que realiza este ciclo se denomina máquina de Carnot.
Como todos los procesos que tienen lugar en el ciclo ideal son reversibles, el ciclo puede invertirse. Entonces la máquina absorbe calor de la fuente fría y cede calor a la fuente caliente, teniendo que suministrar trabajo a la máquina. Si el objetivo de esta máquina es extraer calor de la fuente fría se denomina máquina frigorífica, y si es aportar calor a la fuente caliente, bomba de calor.
Rendimiento térmico: El rendimiento térmico o eficiencia de una máquina térmica es una magnitud de proceso y adimensional, definida como el cociente de la energía que deseamos obtener de dicha máquina y la energía que se debe transferir para su funcionamiento. Se designa con la letra griega η:
Dependiendo del tipo de máquina térmica considerada, la transferencia de estas energías se realizará en forma de calor, Q, o de trabajo, W.
W=Q1-Q2, siendo Q1>Q2
El rendimiento viene dado por: T1-T2/T1, T es la temperatura en Kelvin.
El rendimiento viene dado por: T1-T2/T1, T es la temperatura en Kelvin.